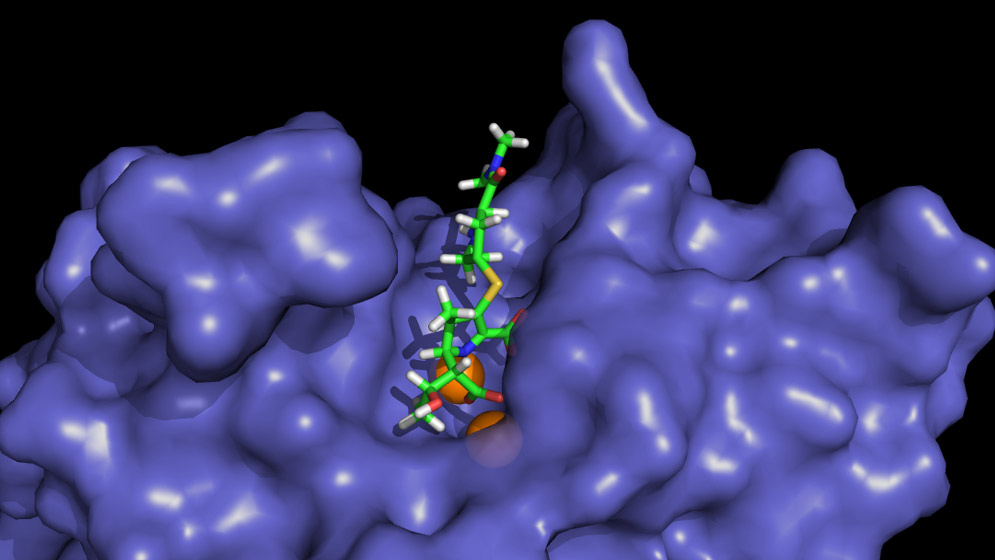
Estructura de la proteína NDM-1, responsable de la resistencia bacteriana a antibióticos beta-lactámicos, con y sin antibiótico (imipenem) unido en su sitio catalítico. Imagen: Gentileza CONICET.

La penicilina, descubierta en 1928 por Alexander Fleming, permitió salvar millones de vidas en la Segunda Guerra Mundial y cambió el rumbo de la historia. Desde entonces se produjeron numerosos antibióticos similares a la penicilina, llamados antibióticos β-lactámicos. Estos compuestos, obtenidos a partir de fuentes naturales o mediante síntesis química, permitieron el tratamiento de diferentes infecciones bacterianas y contribuyeron a que durante el siglo pasado se alargue notablemente la expectativa de vida de la población. Pero, en contrapartida, su uso excesivo o indebido dio lugar a la aparición de bacterias resistentes.
“Actualmente existen superbacterias capaces de sobrevivir a la acción simultánea de varios antibióticos, y que están diseminadas en todo el mundo”, explica Alejandro Vila, investigador superior del CONICET y director del Instituto de Biología Molecular y Celular de Rosario (IBR, CONICET-UNR). Estas cepas son un serio problema para la salud de la población mundial y nos enfrentan a una situación sin precedentes: que no haya terapias efectivas para contener infecciones que han sido tratables hasta hoy.
Para diseñar nuevos fármacos es necesario conocer las estrategias de defensa de las bacterias o la estructura de las moléculas involucradas. El equipo de trabajo de Vila descubrió que el mecanismo químico que usan estos microorganismos para bloquear los antibióticos es similar en distintas especies, lo que permite imaginar tratamientos quimioterapéuticos efectivos frente a un amplio espectro bacteriano.
El mecanismo químico que usan las bacterias para bloquear los antibióticos es similar en distintas especies.
Los resultados de fueron publicados en la revista científica Nature Communications. El trabajo fue co-dirigido por Alejandro Vila y Leticia Llarrull, investigadora adjunta del CONICET en el IBR. María Natalia Lisa, del Institut Pasteur de Montevideo, y Antonela Palacios, becaria doctoral en el IBR, compartieron la primera autoría, y de la investigación participaron Mariano González, del IBR, y Diego Moreno, investigador adjunto del CONICET en el Instituto de Química Rosario (IQUIR, CONICET-UNR), en colaboración con científicos de Estados Unidos y el Reino Unido.
“Vimos que todas las enzimas estudiadas forman los mismos intermediarios y que, más allá de las diferencias en la estructura, todas utilizan el mismo mecanismo químico”, indicó Antonela Palacios, y agrega- “el hallazgo de un punto en común entre proteínas de diferentes familias permite imaginar estrategias para bloquear la actividad de todas ellas al mismo tiempo”.
Uno de los principales mecanismos bacterianos para sobrevivir a la acción de los antibióticos β-lactámicos es la producción de enzimas capaces de degradarlos, llamadas β-lactamasas. Los carbapenemes son una clase de antibióticos β-lactámicos que escapan a la acción de la mayoría de estas enzimas y son la última línea de defensa frente a bacterias multirresistentes. Sin embargo, las bacterias evolucionaron y muchas son hoy capaces de sobrevivir a la acción de los carbapenemes.
“En nuestro equipo estudiamos una clase de β-lactamasas dependientes de zinc que son particularmente efectivas frente a carbapenemes”, comenta María Natalia Lisa, una de las autoras quien investigó el tema en el IBR y ahora está en el Instituto Pasteur de Montevideo, Uruguay. “Entre estas enzimas existen tres familias que tienen diferencias en su sitio activo, el lugar al que se une el antibiótico para ser degradado, lo que llevaba a pensar a la comunidad científica que no sería posible encontrar un único compuesto capaz de bloquear la acción de todas las familias”.
En este trabajo caracterizaron las especies químicas presentes a lo largo de la inactivación de distintos carbapenemes por metalo-β-lactamasas de diversas familias y origen, e “intermediarios de reacción” formados durante la ruptura del antibiótico. Los intermediarios son especies químicas que se forman durante períodos muy cortos de tiempo –milésimas de segundos-, lo que hace que estos complejos sean muy difíciles de estudiar.
Estos resultados abren puertas hacia nuevas líneas de investigación dirigidas al diseño racional de inhibidores de metalo-β-lactamasas que sean capaces de prolongar la utilidad de los antibióticos actualmente disponibles.
45 de cada 10.000 personas sufren infecciones de superbacterias en la Ciudad de Buenos Aires. En el país, la tasa es de 9 cada 10 mil.
Es importante destacar que estos resultados aparecen en un contexto de alerta, cuando en Argentina el Servicio de Antimicrobianos de la Administración Nacional de Laboratorios e Institutos de Salud ‘Dr. Carlos G. Malbrán’ ha informado que 9 de cada 10 mil personas internadas sufren infecciones por superbacterias, en tanto que en la Ciudad de Buenos Aires esa cifra se quintuplica.
En Estados Unidos y en Europa al menos 50 mil personas mueren cada año debido a infecciones con bacterias resistentes, estimándose que, de mantenerse las tendencias actuales, en 2050 las mismas causarán más víctimas que el cáncer.
Asimismo, informes recientes señalan que en Estados Unidos y en Europa al menos 50 mil personas mueren cada año debido a infecciones con bacterias resistentes, estimándose que, de mantenerse las tendencias actuales, en 2050 las mismas causarán más víctimas que el cáncer. Sin embargo, el trabajo presentado se comenzó hace cerca de 8 años, a raíz de observaciones iniciales realizadas hace más de 10 años en el grupo y gracias a aportes sostenidos del CONICET, de la ANPCyT y de los Institutos Nacionales de la Salud (NIH) de Estados Unidos a lo largo de todo ese tiempo.
EQUIPO

Maria Natalia Lisa, Diego Moreno, Alejandro Vila, Antonela Palacios, Leticia Llarrull y Mariano Gonzalez. Foto: IBR. Gentileza: CONICET.
María Natalia Lisa. IBR e Institut Pasteur de Montevideo, Montevideo, Uruguay.
Antonela R. Palacios. Becaria doctoral del CONICET. IBR.
Mahesh Aitha. Miami University, Estados Unidos.
Mariano M. González. IBR.
Diego M. Moreno. Investigador adjunto del CONICET. Instituto de Química Rosario (IQUIR, CONICET-UNR).
Michael W. Crowder. Miami University, Estados Unidos.
Robert A. Bonomo. Louis Stokes Cleveland Department of Veterans Affairs Medical Center, Cleveland, Ohio, Estados Unidos. Case Western Reserve University School of Medicine, Cleveland, Ohio, Estados Unidos. Center forAntibiotic Resistance and Epidemiology, Cleveland, Ohio, Estados Unidos.
James Spencer. University of Bristol Biomedical SciencesBuilding, University Walk, Bristol, Reino Unidos.
David L. Tierney. Miami University, Estados Unidos.
Leticia I. Llarrull. Investigadora adjunta del CONICET. IBR. Universidad Nacional de Rosario.
Alejandro J. Vila. Investigador superior del CONICET. IBR. Universidad Nacional de Rosario.
Cómo comunicarse:
Redacción: [email protected]
Lectores: [email protected]
Equipo de Investigación: [email protected]






































